La ciencia y la medicina son estudios increíblemente complejos que con frecuencia se contradicen, se corrigen y se autoalimentan. Por ello, no es de extrañar que estemos apenas raspando la superficie de un sistema sumamente intrincado de comunicación celular llamado “el sistema endocannabinoide. Este sistema de receptores, enzimas y moléculas de homeoestasis o balance corporal está íntimamente relacionado con el establecimiento, la modulación, y el mantenimiento de los múltiples procesos metabólicos y sistémicos que rigen nuestro cuerpo.

En 1993, el profesor y doctorado en ciencias checo Lumir Ondřej Hanuš y el farmacéutico estadounidense William Anthony Devane describieron por primera vez la estructura molecular de lo que hoy conocemos como “Araquidoniletalonamida” o “Anandamida” en el tejido cerebral de un cerdo. Este descubrimiento hecho en el laboratorio del Profesor Mechoulam significaría el inicio de una revolución en la medicina cannábica.

La Anandamida es parte de una serie de moléculas llamadas “Endocannabinoides”, “Endo” queriendo decir “de adentro” y “Cannabinoides” las moléculas provenientes del cannabis que se unen a los receptores de nuestro cuerpo, osea, los cannabinoides naturales producidos por el cuerpo humano. Sus funciones e involucramiento en el cuerpo son tan complejas que todavía se siguen estudiando sus efectos en cada una de las partes de nuestro sistema. Lo que sabemos es que es una molécula derivada del ácido araquidónico, es lipídica, y se une a los receptores CB1 a nivel central y CB2 a nivel periférico, los cuales están unidos a proteínas G y segundos mensajeros como mediadores químicos.

Tanto la anandamida como el “2 AraquidonilGlicerol” o “2AG” son endocannabinoides, y cada año se descubren más enfermedades, trastornos, y síndromes que tienen relación con su disfunción, falta, o desequilibrio.
Tal es el caso del Trastorno del espectro autista (TEA). De acuerdo al manual diagnóstico y estadístico de desordenes mentales, el TEA es considerado como un grupo heterogéneo de condiciones neurológicas que cursan con funciones de comunicación social dañada y patrones repetitivos de comportamiento o de interés que emergen durante el periodo de desarrollo. En algunos grupos de pacientes con TEA, existen síntomas comunes asociados como convulsiones, ansiedad, discapacidad intelectual, disfunción motora, respuestas alteradas a estímulos sensoriales y al sueño, además de alteraciones metabólicas.
Debido a que aún no sabemos todas la causas fisiopatológica del trastorno, y además existen tantas mutaciones genéticas, no se ha podido encontrar los caminos farmacéuticos necesarios para tratar el TEA de forma directa desde el punto de vista farmacológico, sin embargo, es usual utilizar varios tipos de fármacos antipsicóticos, anticonvulsivos, antidepresivos y estimulantes para tratar sus manifestaciones. Ya que muchos de estos medicamentos presentan múltiples efectos secundarios deletéreos para la calidad de vida tanto de los pacientes como de sus padres, es importante explorar nuevas opciones de tratamiento para un trastorno que aún desconocemos en gran medida.
En el 2013, se descubrió que varias anomalías generadas por diferentes mutaciones en unas moléculas llamadas “neuroliginas-3” en las sinapsis neuronales están ligadas al autismo ya que interfieren con la inhibición sináptica retrógrada. Existe evidencia para pensar que las neuroliginas-3 son moléculas involucradas en el “tono” del sistema endocannabinoide por medio de señales químicas. (Földy et al, 2013) a partir de ese momento se ligó por primera vez al autismo con el SEC.

Mutaciones en proteínas de adhesión entre células como las neuroliginas-3 están asociadas a problemas en la inhibición retrógrada de la excitación neuronal mediada por el sistema endocannabinoide, dando como resultado, síndromes que cursan en un 30% de las veces, con TEA. (Krueger et al, 2013)
Más adelante, en el año 2016, se volvió a tocar el tema al generar evidencia a partir de modelos de TEA en ratones. Ustedes se preguntarán: ¿Cómo sabemos si un ratón tiene TEA? Bueno, se propone que los ratones que exhiban patrones de comportamiento obsesivos y restrictivos como cavar de forma ininterrumpida, acicalarse obsesivamente y la disminución de sus capacidades sociales como ruidos ultrasónicos, comunicación olfatoria y paradigmas de acercamiento social en roedores de este tipo.
Además, se evaluó si, además, presentaban trastornos epilépticos, pérdida de capacidad cognitiva, ansiedad, alteraciones en el sueño, respuesta a estímulos sensitivos e incapacidad motora, usuales en el TEA.
Al bloquear la enzima que destruye a la anandamida llamada “FAAH” (Fatty acid amide hydrolase) en cerebros de ratones, se pudo observar mejoría en aspectos de socialización independientes de respuesta a la ansiedad, lo que sugiere que el desbalance en las concentraciones de la anandamida en el cerebro podría tener implicaciones en la generación de síndromes y comportamientos típicos encontrados en el TEA. (Wei et al, 2016)
Además, en 2017, encontraron que aquellos ratones en los cuales eran inducidos mutaciones y riesgo aumentado de tener TEA, la administración de varios tipos de moléculas sintéticas, entre ellas: el rimonabant (antagonista del receptor Cb1), y otras como URB597 y JZL184 (moléculas sintéticas parecidas a la anandamida, e inhibidores de su recaptura) evidenciaron mejoría en problemas sociales, déficit social, respuestas ansiosas a estímulos, disminución en déficit cognitivo y disminución en convulsiones generadas por sonido. (Zamberletti et al, 2017)

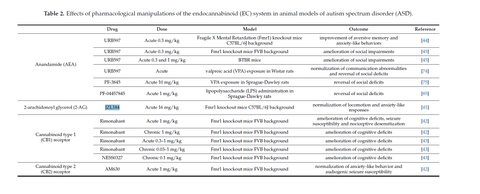
Sin embargo, el estudio más interesante respecto al sistema endocannabinoide, la Anandamida, y el TEA, es el hecho en 2018, ya que, por primera vez en la historia, tenemos información clínica (aplicada en humanos) y evidencia científica de que las concentraciones de Anandamida en la sangre están DIRECTAMENTE relacionadas con el riesgo de entrar dentro de algún área del trastorno del espectro autista. (Kahrson et al, 2018)

Ya que, al medir las concentraciones sanguíneas de Anandamida en pacientes que habían sido reclutados anteriormente para el estudio de las razones genéticas y hereditarias del autismo (N= 112 niños), se pudo evidenciar:
Esto, nos sugiere que el sistema endocannabinoide, sus enzimas, las moléculas endógenas, y sus caminos neuroquímicos, tienen una profunda importancia en el tratamiento del TEA y sus efectos en la vida diaria de estos pacientes.
Aunque todavía falta mucha investigación por hacer, este tipo de investigaciones y pruebas clínicas nos ayudan a entender el papel que tiene la dosificación controlada y médicamente seguida de fitocannabinoides (cannabinoides de la planta del cannabis) como el CBD, el THC y el CBG, en el posible tratamiento farmacológico de pacientes que cursan con problemas de comportamiento, sociales y cognitivos, ya que se unen y modulan los mismos caminos neuronales y neuroquímicos que los endocannabinoides como la Anandamida. Al final, lo que encontramos es una pieza importante del gran y complejo rompecabezas que es el Trastorno del espectro autista.
Evidence for a Common Endocannabinoid-Related Pathomechanism in Autism Spectrum Disorders(Krueger et al): https://www.sciencedirect.com/science/article/pii/S0896627313003619#bib6
Enhancement of Anandamide-Mediated Endocannabinoid Signaling Corrects Autism-Related Social Impairment (wei et al, 2016): https://www.liebertpub.com/doi/10.1089/can.2015.0008
The Endocannabinoid System and Autism Spectrum Disorders: Insights from Animal Models (Zamberletti et al): https://www.mdpi.com/1422-0067/18/9/1916
Plasma anandamide concentrations are lower in children with autism spectrum disorder (Kahrson et al, 2018): https://molecularautism.biomedcentral.com/articles/10.1186/s13229-018-0203-y
Autism-associated neuroligin-3 mutations commonly disrupt tonic endocannabinoid signaling(Földy et al, 2013): https://pubmed.ncbi.nlm.nih.gov/23583622/